Enfermedad Celíaca (EC) - Dra. Marta Porta Tormo
12 de Mayo de 2021
Gastroprimaria

La enfermedad celíaca (EC) es un trastorno sistémico de base inmunológica, crónico, causado por la ingesta de la proteína del gluten (gliadina) y otras proteínas afines. No afecta a cualquier persona, sino que afecta a individuos genéticamente susceptibles. (1)
Aunque se trata de una enfermedad poligénica, destaca la fuerte asociación con genes localizados en la región HLA (Human Leukocyte Antigen). La gran mayoría de los pacientes celíacos presentan el heterodímero HLA-DQ2, en concreto la variante DQ2.5 (90-96%). El resto de celíacos presentan mayoritariamente el heterodímero HLA -DQ8. (2)
Los genes HLA-DQA1 y HLA-DQB1 codifican las subunidades (? y ? respectivamente) de la proteína heterodimérica HLA-DQ. El genotipado de estos loci o, en su defecto, la determinación de los alelos específicos que codifican DQ2.5 y DQ8 constituyen la base del test genético que puede utilizarse en el diagnóstico de la EC. (2)
El test genético presenta un elevado valor predictivo negativo (cercano al 100%) pero carece de elevado valor predictivo positivo. Por tanto, el test genético no debe emplearse por sí solo para diagnosticar EC, ya que entre el 35-40% de la población general presenta los heterodímeros HLA-DQ2 y/o HLA-DQ8, mientras que solo el 1% es celíaco. (2)
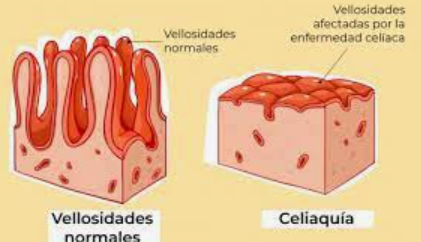
En personas genéticamente predispuestas, la ingesta del gluten desencadena una respuesta anómala en el sistema inmune provocando inflamación de la mucosa del intestino delgado y atrofia de sus vellosidades intestinales, generando como consecuencia una malabsorción de nutrientes. (3)
El gluten es una proteína presente en algunos cereales como el trigo, cebada, centeno, espelta, kamut, triticale (híbrido del trigo y cebada) y posiblemente la avena. (4) Una dieta sin gluten es el tratamiento que deben seguir los pacientes celíacos de por vida desde que se les diagnostica la enfermedad. La dieta sin gluten conduce a la desaparición de los síntomas, la normalización de las pruebas serológicas y la resolución de las lesiones histológicas en la gran mayoría de los pacientes con EC. (1)
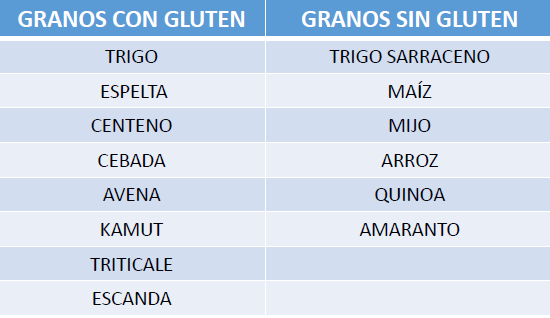
Tabla 1-Elaboración propia
EPIDEMIOLOGÍA
La celiaquía afecta a todos los grupos de edad y se puede desarrollar en cualquier momento de la vida, aunque se estima que la prevalencia es mayor en la infancia (prevalencia 1/71 en población infantil y 1/357 en población adulta). En cuanto al sexo, afecta más a mujeres (relación mujer/hombre 2:1).
La prevalencia de EC es aproximadamente del 1%, es decir se estima que existe un celíaco por cada 100 habitantes. Sin embargo, se considera que el diagnóstico de la EC tiene las características de un iceberg, ya que se cree que existen muchos casos infradiagnosticados. (1)
ETIOPATOGENIA
La ingesta de gluten es el principal factor ambiental implicado en el desarrollo de la EC y se relaciona tanto con la cantidad como con la frecuencia de su ingesta. No obstante, también existen otros factores que podrían contribuir en el desarrollo de la enfermedad. (1)
MANIFESTACIONES CLÍNICAS
La sintomatología puede ser muy variable de unas personas a otras y diferir según la edad. (1)
La clínica típica de los pacientes celíacos es la gastrointestinal: diarrea, distensión abdominal, pérdida de peso, dolor abdominal, náuseas, vómitos, meteorismo, pérdida de masa muscular. (5)
El patrón clásico de la enfermedad celíaca no es el más común, especialmente en adultos, donde los síntomas gastrointestinales inespecíficos o las manifestaciones extradigestivas pueden ser los síntomas predominantes. (1)
En la población infantil y adolescente se debe sospechar EC con síntomas clásicos de malabsorción y deterioro nutricional, pero también con síntomas extradigestivos: estancamiento del crecimiento, talla corta, retraso puberal, amenorrea, anemia por déficit de hierro o ferropenia, fatiga crónica, aftas bucales recurrentes, dermatitis herpetiforme, fracturas óseas ante traumatismos banales u osteopenia. (1)
Los síntomas gastrointestinales que aparecen en el adulto dependen de la longitud del intestino afectado y de la intensidad de las lesiones histológicas. Diferenciamos un "patrón clásico" ,en el que predomina la diarrea con esteatorrea y pérdida de peso; de un "patrón no clásico" caracterizado por síntomas gastrointestinales inespecíficos tales como pirosis, dispepsia, flatulencia, meteorismo, distensión abdominal y cambios en la frecuencia intestinal.
En la población adulta la presentación de un cuadro clínico de malabsorción con diarrea y pérdida de peso es excepcional. La enfermedad se diagnostica entre la cuarta y sexta década de la vida, con una edad media de presentación de 40-45años. En muchos casos la enfermedad ha permanecido de forma subclínica durante muchos años o incluso ha estado latente sin ningún tipo de manifestación clínica hasta que en cierto momento se inician los primeros síntomas. (1)

Tabla 2- Extraída de: https://celiacos.org/enfermedad-celiaca/que-es-la-enfermedad-celiaca/
También debemos tener en cuenta los síntomas extradigestivos en la EC del adulto. Estos síntomas se producen principalmente por la malabsorción de micronutrientes. La anemia o la ferropenia es una manifestación común en la EC y puede producirse por la malabsorción en el intestino de hierro, folato y vitamina B12. En cuanto al metabolismo óseo nos podemos encontrar con osteopenia y osteoporosis debido a la malabsorción de calcio y vitamina D. En la EC también se ven enfermedades neurológicas como la ataxia-gluten, que produce un daño inmunológico a nivel del cerebelo, cordones posteriores de la médula y nervios periféricos y provoca diversas formas de neuropatía periférica con parestesias, debilidad muscular y pérdida de sensibilidad.
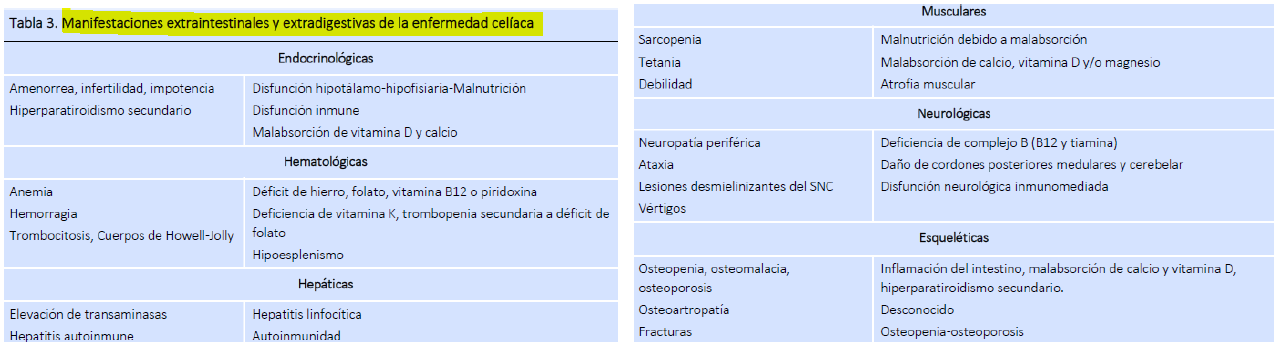
Tabla 3- Kelly CP. Celiac disease. In: Feldman M, Friedman L, Brandt L, editors. Sleisenger and Fordtran?s Gastrointestinal and Liver Disease. Philadelphia: Elservier-SANDERS; 2016.p. 1849-72
DIAGNÓSTICO
El diagnóstico de la enfermedad celíaca ha cambiado en los últimos años. Se basa fundamentalmente en la determinación de anticuerpos específicos en sangre y la obtención de una biopsia intestinal. La biopsia se considera la prueba de referencia para demostrar las alteraciones de atrofia vellositaria. Sin embargo, gracias al avance tecnológico en el desarrollo de nuevos anticuerpos, se ha conseguido que en algunos niños que presentan una combinación de anticuerpos a niveles determinados pueda realizarse el diagnóstico sin necesidad de biopsia. (3)
Es muy importante no caer en el error de retirar el gluten de la dieta hasta que no tenga un diagnóstico definitivo de EC.
La OMS no recomienda realizar cribado poblacional de la EC porque no se conoce la historia natural de la enfermedad en pacientes asintomáticos. Únicamente se debe recomendar cribado en pacientes asintomáticos en los siguientes casos: familiares de 1er grado de individuos con enfermedad celíaca, Diabetes Mellitus tipo 1, Síndrome de Down, Enfermedad tiroidea autoinmune, Déficit selectivo de inmunoglobulina A, enfermedad hepática autoinmune, Síndrome de Turner, Síndrome de Williams y enfermedad de Addison. (1)
- ESTUDIO SEROLÓGICO
-
Anticuerpos antitransglutaminasa tisular 2 (anti-TG2) isotipo inumnoglobulina A (IgA): son los más utilizados para el diagnóstico. Se caracterizan por tener elevada sensibilidad (>95%), pero especificidad más baja (90%), ya que suelen estar presentes a títulos bajos en enfermedades autoinmunes, hepáticas o infecciones. Se obtienen mediante técnica ELISA. Permiten diagnosticar a pacientes con EC con déficit selectivo de IgA (IgA < 0.07mg/dl).
-
Anticuerpos anti-endomisio (anti-EMA) isotipo IgA: tienen baja sensibilidad (80-90%), pero especificidad muy elevada (cercana al 100%). Se obtienen mediante inmunofluorescencia. Se suelen emplear para confirmar resultados positivos cuando los anti-TG2 salen positivos pero con resultados no muy altos.
-
Anticuerpos anti-péptidos de gliadina desamidada (anti-DGP) isotopos IgG e IgA: tienen baja sensibilidad (80-95%) y baja especificidad (80-90%). Se obtienen mediante ELISA. Son anticuerpos dirigidos frente a péptidos inmunopredominantes producidos durante la digestión de la gliadina y desamidados en la mucosa intestinal por TG2.
-
- LIMITACIONES:
- Los anticuerpos anti-TG2 y anti-EMA no pueden detectarse en niños menores de dos años. En estos casos de niños <2años se deben utilizar los anti-DGP, ya que son el primer marcador en positivizar.
- La OMS considera que la EC no reúne criterios para hacer cribados poblacionales, por lo que solo se deben emplear ante clínica que nos haga sospechar posible EC.
- Los anticuerpos no sirven para el seguimiento de la EC, ya que no permiten detectar transgresiones dietéticas.
- Los anti-TG2 IgA pueden ofrecer resultados falsos negativos en: niños menores de 2 años, pacientes con déficit selectivo de IgA y en niños y adultos con lesión histológica sin atrofia (Marsh 1 y 2). (1)
- Con la primera determinación de anti-TG2 debe realizarse siempre una cuantificación de IgA sérica total, ya que en caso de déficit selectivo de IgA, deben usarse los anti-TG2 IgG, ani-EMA IgG o anti- DGP IgG. (6)
- BIOPSIA DE INTESTINO DELGADO
La realización de biopsias de intestino delgado es fundamental para el diagnóstico de EC. Se aconseja realizar al menos 4 biopsias de duodeno y 2 bulbares, ya que las lesiones pueden ser parcheadas. La biopsia siempre debe llevarse a cabo antes de proceder a la retirada del gluten de la dieta.
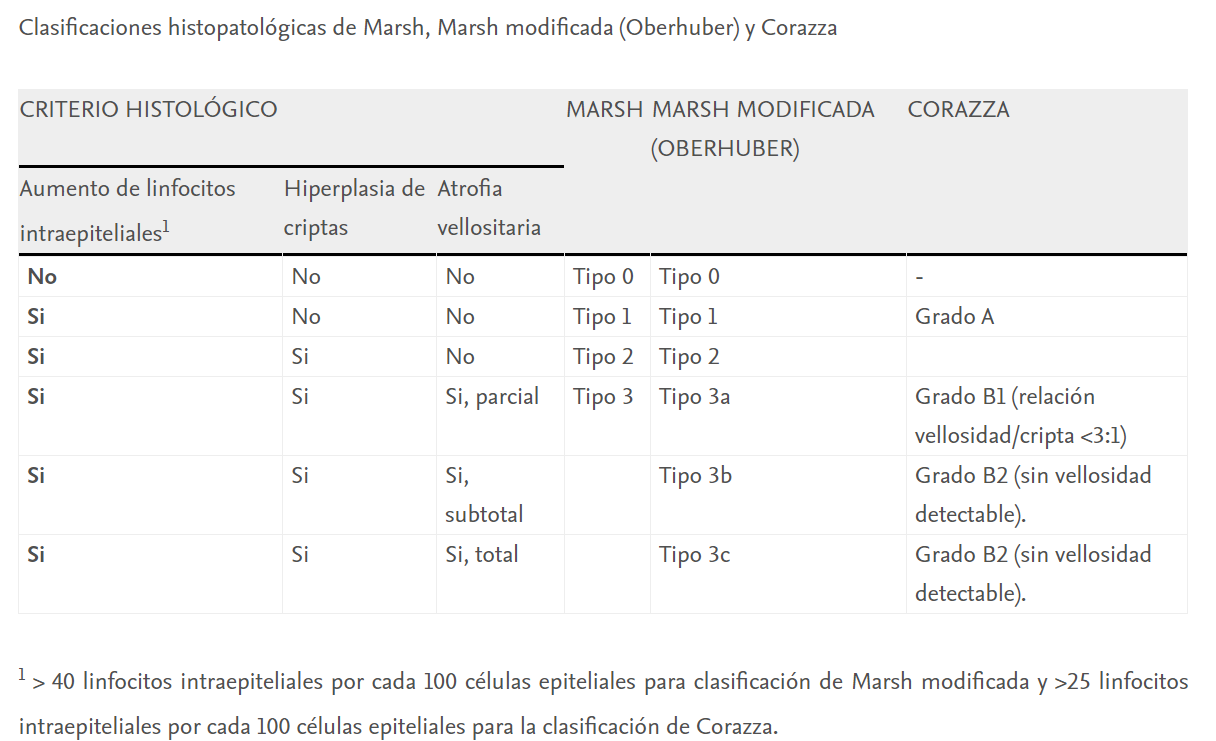
El resultado anatomopatológico permite confirmar la existencia de lesiones compatibles y establecer el estadío de la lesión según la clasificación de Marsh. Según esta clasificación se establecen los siguientes grados:
-
Marsh 0: mucosa preinfiltrativa
-
Marsh 1: incremento en el número de linfocitos intraepiteliales
-
Marsh 2: hiperplasia de criptas
-
Marsh 3a: atrofia vellositaria parcial
-
Marsh 3b: atrofia vellositaria subtotal
-
Marsh 3c: atrofia vellositaria total (1)

Para el diagnóstico de EC se requiere la presencia de lesión Marsh 2 o 3, aunque ninguna lesión es patognomónica. (6)
La clásica clasificación de Marsh fue reemplazada en el año 1999 por Oberhüber proponiendo una mejor estandarización con 6 tipos. En 2007 se publicó una nueva clasificación por Corazza que era más simple, con solo tres categorías y con una reproducibilidad inter-observador significativamente superior a la de la clasificación modificada de Marsh. No existen sugerencias formales sobre cuál utilizar. (7) Generalmente se emplea la clasificación de Marsh modificada por Oberhüber. (6)
LIMITACIONES:
-
Las lesiones Marsh tipo 1, 2 y 3 se consideran compatibles con el diagnóstico de EC, sin embargo, no son patognomónicas.
-
Las lesiones Marsh 1 pueden también encontrarse en otras patologías como la infección de Helicobacter pylori, consumo frecuente de antiinflamatorios no esteroideos, estados de sobrecrecimiento bacteriano intestinal, gastroenteritis por virus, infestación por Giardia lamblia o enfermedad de Crohn.
Los nuevos conocimientos, especialmente los avances en la serología específica, han hecho que los criterios diagnósticos de la EC también cambien a lo largo de los años gracias a la identificación de anti-TG2 y anti-EMA La precisión de estos marcadores serológicos ha permitido que se replantee el papel de la biopsia intestinal en el diagnóstico de la EC.
En el año 2012 se publicaron unas directrices de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) para el diagnóstico de la EC, estableciendo que la biopsia intestinal podía omitirse en casos seleccionados: pacientes sintomáticos con anti-TG2 elevados diez veces por encima del valor normal, anti-EMA positivos en una segunda muestra de suero y HLA-DQ2 o DQ8. En 2020 se han actualizado dichas recomendaciones, estableciendo que si se cumplen criterios serológicos (anti-TG2 elevados diez veces por encima del valor normal y anti-EMA positivos en otra muestra diferente) se pueden ampliar los casos en que puede omitirse la biopsia intestinal a casos asintomáticos y no sería necesario el estudio HLA. (6)
Por tanto, la biopsia intestinal puede omitirse en el caso de niños o adolescentes que cumplan los criterios mencionados, sin embargo, en adultos la biopsia intestinal sigue siendo obligatoria en todos los casos. (1)
- ESTUDIO GENÉTICO
Aunque no se incluye en el protocolo inicial de diagnóstico, el estudio genético puede ser muy útil en algunas situaciones:
-
Pacientes de diagnóstico incierto con sospecha clínica fundada pero serología negativa.
-
Para identificar individuos de riesgo elevado entre familiares de primer grado y pacientes con enfermedades asociadas que tienen serología positiva y biopsia normal.
-
De acuerdo con los nuevos criterios de ESPGHAN, el estudio genético debe realizarse en niños con sospecha clínica fundada y anti-TG2 muy elevados para poder realizar el diagnóstico sin necesidad de biopsia.
TRATAMIENTO
El único tratamiento eficaz de la EC es una dieta estricta sin gluten. Por tanto, se deben excluir de la dieta todos los alimentos que contengan gluten. Respecto a la avena comentar que no es un alimento con gluten, sin embargo hay que tener en cuenta el riesgo de contaminación por gluten en los productos que contienen avena.
La espiga barrada es el símbolo internacional sin gluten y actualmente está regulado por la Sociedad de Asociaciones de Celíacos de Europa (AOECS). Siempre debe quedar garantizada la seguridad de ausencia de contaminación por gluten en el producto alimentario. (1)

- NUEVAS ESTRATEGIAS TERAPÉUTICAS
Se considera que los probióticos podrían jugar un papel importante como complemento a la dieta sin gluten para atenuar los parámetros inflamatorios alterados en individuos celíacos y contribuir a la recuperación de la homeostasis inmune en pacientes con EC. (1)
Varios estudios asocian alteraciones en la microbiota intestinal con mayor predisposición a padecer EC. En la celiaquía se detecta un aumento de Bacteroides y una disminución de Bifidobacterium. Se han propuesto cepas bacterianas de Bifidobacterium Lactis y Bifidobacterium Longum como tratamiento complementario de la dieta sin gluten de pacientes con enfermedad celíaca. Estudios con Bifidobacterium Longum CECT 7347 demuestran que la administración de esta cepa concreta de probiótico, puede ejercer efectos protectores en un modelo animal de enteropatía inducida por gliadina, ya que atenúa la producción de citocinas inflamatorias y la respuesta inmune mediada por células T CD4+. Esta cepa probiótica tiene un papel antiinflamatorio en la EC, reduce los efectos tóxicos de la gliadina , ayudando a reestablecer la disminución de la altura de las vellosidades provocada por la propia enfermedad. (8-12)
COVID Y ENFERMEDAD CELÍACA
No existen datos que sugieran que la enfermedad celíaca predisponga a padecer la enfermedad por coronavius con mayor frecuencia ni mayor gravedad que la población general.
No se considera que la exposición ocasional al gluten en un paciente celíaco implique mayor riesgo de enfermedad grave por COVID-1, pero es necesario mantener una dieta estricta sin gluten como tratamiento de la enfermedad.
Se recomienda estar vacunado de neumococo y de gripe ante la posibilidad de coinfecciones que empeoren el pronóstico de la COVID-19. (3)
BIBLIOGRAFÍA
-
Grupo de trabajo del Protocolo para el diagnóstico precoz de la enfermedad celíaca. Protocolo para el diagnóstico precoz de la enfermedad celíaca. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Educación del Servicio Canario de la Salud (SESCS); 2018.
-
C.Núñez, JA.Garrote. Grupo de Trabajo de Inmunología y Genética de la Sociedad Española de Enfermedad celíaca (SEEC). Recomendaciones para la elaboración e interpretación de informes genéticos en enfermedad celíaca. Rev. esp.enferm.dig.vol.110 no.7 Madrid Jul.2018
https://dx.doi.org/10.17235/reed.2028.5269/2017
-
Guía para familias sobre trastornos digestivos en tiempos de pandemia. SEGHNP; 2020
-
Tabla orientativa alimentos con y sin gluten. Disponible en: https://www.celiacscatalunya.org/pdfs/apto_no_apto.pdf
-
Federación de Asociaciones de Celíacos de España. Disponible en: https://celiacos.org/enfermedad-celiaca/que-es-la-enfermedad-celiaca/
-
E. Román Riechmann, G. Castillejo de Villasante, ML. Cilleruelo Pascual, E. Donat Aliaga, I. Polanco Allué, F. Sánchez- Valverde, et al. Aplicación racional de los nuevos criterios de la European Society for Paediatric Gatroenterology Hepatology and Nutrition (ESPGHAN) 2020 para el diagnóstico de la enfermedad celíaca. An Pediatr., 92 (2020), pp. 110.e1-110.e9
-
F. Moscoso J, R. Quera P. Enfermedad celíaca: revisión. Rev Med. Clin. Las Condes. Vol. 26.Num 5. (2015) , p 613-627
https://doi.org/10.1016/j.rmclc.2015.09.007
-
De Palma G, Kamanova J, Cinova J. Modulation of phenotipic and functional maturation of dentritic cell by intestinal bacteria and gliadin: relevance for celiac disease. Journal of leukocyte, 2012. Soc Leukocite Biology
-
Olivares M, Castillejo G, Varea V. Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects of Bifidobacterium longum CECT 7347, a probiotic able to reduce the toxicity and inflammatory. J Prob, 2013-omicsonline.org
-
Laparra JM, Olivares M, Gallina O, Sanz Y. Bifidobacterium longum CECT 7347 modulates immune responses in a gliadin-induced enterophaty animal model. PLoS One, 2012-journals.plos.org
-
Medina M, De Palma G. Bifidobacterium strains suppres in vitro the pro-inflamatory milieu triggered by the large intestinal microbiota of celiac patients, Journal of inflamation 2008
-
E Chenoll, FM Codoñer, A Silva, A Ibañez. Genomic sequence and pre-clinical safety assessment of Bifidobacterium longum CECT 7347, a probiotic able to reduce the toxicity and inflammatory.J Prob, 2013-omicsonline.org

