¿Qué debería saber el médico de familia sobre la enfermedad de Crohn? - Dra. Silvia Alcalde Muñoz.
6 de Abril de 2021
Gastroprimaria
La enfermedad de Crohn (EC) es un trastorno inflamatorio crónico con afectación preferente por íleon y colon, aunque hasta en un 10-15% puede asociar lesiones en el tracto digestivo superior(1). Su nombre se debe al Dr Burril Bernard Crohn, jefe de gastroenterología del Monte Sinaí, que en octubre de 1932, sistematizó los datos recopilados por los cirujanos Leon Ginzburg y Gordon D. Oppeheimer en un artículo publicado por el JAMA (Journal of American Medical Association) distinguiendo claramente la enteritis regional de la tuberculosis intestinal y resaltando sus principales características clínicas, radiológicas e histológicas(2).
La EC es más frecuente en países desarrollados, zonas urbanas y clases sociales altas, con un pico en la tercera década (10-15% presentan más de 60 años y un tercio presenta menos de 21 años), y ligeramente más frecuente en mujeres (a excepción lugares como Asia, con una incidencia elevada). A mayor edad de inicio, más común la afectación única del colon (48% en los diagnosticados antes de los 20 años; 20% antes de los 20).(1)
Su etiología es desconocida, e intervienen tanto factores genéticos (se han descrito más de 200 genes con polimorfismos compartidos con otras enfermedades autoinflamatorias) como ambientales (menor diversidad de los microorganismos que conforman la microbiota). En individuos con disbiosis y predisposición genética, la presencia de un factor desconocido que alterara la permeabilidad intestinal podría desencadenar una respuesta inmunitaria descontrolada frente a bacterias no patógenas en otras circunstancias(3).
¿QUÉ SÍNTOMAS PRESENTA UN PACIENTE CON EC?
El síntoma más frecuente es la diarrea de más de seis semanas de duración, dolorosa, que no respeta el sueño, con tenesmo e incontinencia y acompañada en la mitad de los casos de moco o sangre, seguida del dolor abdominal (70%) más frecuente en el cuadrante inferior derecho o periumbilical, y pérdida de peso (60%). El paciente también puede presentar astenia, anorexia, sudoración nocturna o fiebre, náuseas y vómitos y manifestaciones perianales. Hasta 30% de los pacientes van a presentar una enfermedad perianal asociada (fístulas, abscesos y/o fisuras anales) (1).
A veces el debut se produce en forma de complicación (megacolon tóxico), pero lo habitual es que el inicio sea insidioso y los síntomas variados, más según edad, afectación sistémica, extensión y localización (la afectación del íleon por ejemplo resulta más asintomática que la del colon), sin que exista correlación con el daño tisular (los brotes pueden cursar con importante astenia y dolor abdominal, y las fístulas/estenosis permanecer asintomáticas durante años)(1).
Las manifestaciones extraintestinales (presentes hasta en el 35%) son más frecuentes si existe afectación del colon. Algunas (artritis, eritema nodoso, aftas orales y epiescleritis) tienen relación con la actividad de la enfermedad, mientras que otras (pioderma gangrenoso, uveítis, sacroileítis, espondilitis y colangitis esclerosante primaria o CEP) llevan un curso independiente. Existe más riesgo de tromboembolismo venoso, nefrolitiasis, litiasis biliares y neuropatía periférica, y al igual que en la Colitis Ulcerosa (CU), la ansiedad y depresión son más frecuentes que en la población general (1).
¿CÓMO SE DIAGNÓSTICA?
No existe una única prueba para el diagnóstico definitivo, sino que éste resulta posible gracias a una combinación de anamnesis, exploración física (incluyendo el tacto rectal para descartar enfermedad perineal) y pruebas complementarias. Debe sospecharse en pacientes con dolor abdominal y diarrea de más de cuatro semanas, pérdida de peso y analítica con elevación de velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) y calprotectinal fecal (CF).
El diagnóstico diferencial debe realizarse con otras enfermedades que cursen con diarrea, principalmente infecciones, fármacos -sobre todo AINES-, trastornos funcionales (síndrome de intestino irritable, SII), síndromes de malabsorción de sales biliares, hemorroides, colitis isquémica o por radiación (especialmente si rectorragia), diverticulitis /apendicitis aguda (especialmente si ileítis), pancreatitis crónica, cáncer de colon o enfermedad celíaca.
PRUEBAS DE LABORATORIO (1)
| RECOMENDADAS | NO DE FORMA SISTEMÁTICA |
|
|
¿QUÉ ES LA CALPROTECTINA FECAL?
La CF es una proteína fijadora de calcio con propiedades antimicrobianas, antiproliferativas y proinflamatorias presente en el citoplasma de los neutrófilos y en menor medida, de monocitos y macrófagos activados. Es liberada en fases precoces del proceso inflamatorio y su concentración en las heces es proporcional a la presencia de neutrófilos en la luz intestinal, con buena correlación con la permeabilidad de la mucosa intestinal. Es resistente a la degradación bacteriana y estable a temperatura ambiente hasta tres días, características que la hacen adecuada para su uso en la práctica clínica. La muestra puede recogerse de cualquier parte y a cualquier hora, pero es importante tener presente que sus niveles descienden en relación con la preparación para la colonoscopia y se eleva por la toma de AINES, por lo que se recomienda suspender éstos dos semanas antes si es posible para evitar falsos positivos. Es el mejor biomarcador de inflamación para la EC en la actualidad, muy valiosa para diferenciar el SII de procesos inflamatorios en pacientes menores de cincuenta años y bajo riesgo de cáncer colorrectal (CCR) con un valor predictivo del 90%, se correlaciona con la actividad endoscópica, se asocia con la respuesta al tratamiento y predice la recaída a corto plazo, incluso en pacientes en remisión endoscópica, por lo que puede ser de gran ayuda para el diagnóstico, la monitorización y la adecuación del tratamiento(3,4). Es importante que las decisiones se tomen basadas en al menos dos determinaciones seriadas y la probabilidad pre-test de que exista o no actividad endoscópica (a mayor probabilidad, más posibilidad de que un valor alto de CF sea un verdadero positivo y viceversa)(4).
Interpretación de la determinación de la calprotectina fecal en diferentes escenarios clínicos(4)
| Situación clínica | Punto corte, ?g/g | Interpretación de los valores |
| Diagnóstico diferencial de clínica digestiva | 50 -100 | <50-100: inflamación intestinal muy improbable. Podrían olvidarse colonoscopias diagnósticas. (Sensibilidad 93%, Especifididad 94%). 100-150: repetir medición en semanas. >150: pruebas adicionales. |
| Predicción de actividad endoscópica EC |
250 150
|
>250?g/g: cólica o ilecólica (S80%, E82%) <150?g/g: exclusivamente ileal (S85%, E81%) |
| Predicción de la recurrencia postquirúrguica en EC | 100 | <100?g/g: recurrencia muy improbable. Periodicidad recomendada: 4-6 meses (S y VPN superiores al 90%) |
| Respuesta al tratamiento de inducción | 150 | <150?g/g tras la inducción (semana 8-12): remisión endoscópica (Sensibilidad del 85% y 81% especificidad) |
| Predicción de la recidiva | 150 | Valores repetidos <150?g/g: recidiva improbable en los 3 meses siguientes. Periodicidad recomendada: 3 -6 meses |
PRUEBAS DE IMAGEN (1 )
1.1.1. Radiografía simple de abdomen: descartar dilataciones intestinales, perforación u
obstrucción intestinal.
1.1.2. Ecografía abdominal: muy sensible para diagnosticar inflamación intestinal pero poco
específica, pudiendo usarse para descartar colelitiasis, litiasis o abscesos.
1.1.3. Resonancia magnética nuclear y tomografía axial computarizada: detectan inflamación
intestinal, diferencian estenosis fibróticas de las inflamatorias y objetivan complicaciones.
LA COLONOSCOPIA EN EL CROHN
Resulta muy útil para confirmar el diagnóstico, localizar y precisar la gravedad de la inflamación, determinar la extensión y obtener muestras para el estudio anatomopatológico, diferenciarla de la CU, detectar las estenosis y descarta malignidad. Es importante que incluya la visualización del íleon terminal y las biopsias sean segmentadas. Se recomienda posponerla en casos graves o si existe elevado riesgo de perforación.
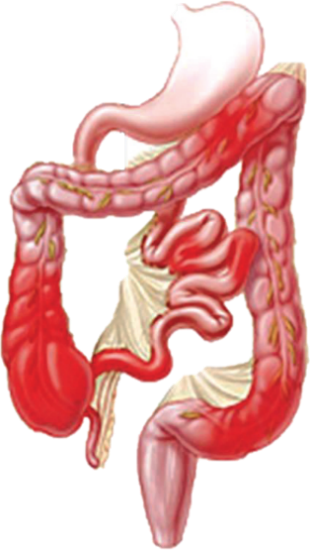
La EC puede afectar a cualquier parte del tubo digestivo, desde boca a ano (un 30% asocia enfermedad perianal, lo que explica sus complicaciones en forma de fístulas, plastrones y abscesos)(1;3) siendo su localización más frecuente el íleon. La afectación que produce es transmural que puede manifestarse con fenotipo inflamatorio, estenosante o fistulizante. La clínica dependerá de la localización de la enfermedad (ileal, cólica, ileocólica o tracto digestivo superior), comportamiento (fenotipo) y la severidad del cuadro, estando estos parámetros recogidos en la Clasificación de Montreal(1;5)
El enema opaco podría plantearse si la colonoscopia resulta incompleta (no recomendado si enfermedad grave) y la gastroscopia estaría indicada si existen síntomas de tracto digestivo superior como epigastralgia, náuseas o vómitos(1).
Clasificación de Montreal de la Enfermedad de Crohn (1,5)
| Edad al diagnóstico |
A1: a partir de de los 16 años A2: entre 17 y 40 años A3: mayor de 40 años |
| Localización |
L1: íleon terminal L2: colon L3: íleo y colon L4: afectación alta |
| Comportamiento |
B1: no estenosante ni penetrante B2: estenosante B3: penetrante P: si existe enfermedad perianal |
| COLONOSCOPIA | ENFERMEDAD DE CROHN | COLITIS ULCEROSA |
| Distribución lesiones | Parcheada y transmural | Difusa y mucosa |
| Afectación íleon terminal | Frecuente | Raro |
| Presencia de úlceras | Sí (en sacabocados) | Raro |
| Estenosis | Frecuentes | Raro |
| Granulomas | Característicos | Muy raros |
Y UNA VEZ DIAGNOSTICADA, ¿ CÓMO SE TRATA? (3;6-7)
En líneas generales, se recomienda evitar el estrés, los AINES (en 1 de cada 3 pacientes pueden causar un brote, pudiendo utilizarse como alternativa paracetamol metamizol, tramadol y COXIB), alopurinol (potencia el efecto de las tiopurinas y la mielotoxicidad) y antidiarreicos como la loperamida. Resulta clave el cese de la actividad tabáquica (menor necesidad de corticoides e inmunomoduladores y menos brotes. Se recomiendan los suplementos con calcio y vitamina D en los pacientes con corticoides y el hierro y vitamina B12 si anemia.
Tratamiento farmacológico
Los principales objetivos son el tratamiento agudo de la enfermedad, el mantenimiento de la remisión el mayor tiempo posible y la reducción de la necesidad de corticoides. Hablamos de remisión clínica (alcanzada normalmente durante el primer año de enfermedad) cuando el número de deposiciones al día es menor de 4, desaparece el sangrado y no se encuentran lesiones en la mucosa. Dentro de los fármacos empleados, algunos sólo son útiles en la inducción de la remisión (corticoides), otros sólo sirven para mantenerla (tiopurinas) y otros cumplen ambos (biológicos).
A. Inducir la remisión
Los corticoesteroides resultan efectivos en la EC activa. Según la localización, se utilizarán corticoides como la budesonida en casos leves a moderados de enfermedad ileocecal. En casos graves o afectación de colon y/o intestino delgado el tratamiento indicado son los corticoides sistémicos (o cirugía). Estos se pueden añadir al tratamiento con inhibidores de la bomba de protones en la afectación gastroduodenal o esofágica. Los anti-TNF (infliximab y adalimumab) se utilizan en caso de refractariedad o resistencia al tratamiento con corticoides. Infliximab es eficaz para el tratamiento de la enfermedad fistulizante.
B. Terapia de mantenimiento
Las tiopurinas y el metrotexato constituyen la base terapéutica de esta fase, siendo de elección los agentes biológicos (infliximab) en caso de refractariedad. Existe controversia en cuanto a la duración del tratamiento. La mesalazina no se recomienda ni para la EC activa ni para el mantenimiento dado que no hay evidencia científica suficiente.
C. Manejo de lesiones cutáneas e infecciones
Aparte del eritema nodoso y pioderma gangrenoso, es necesario evaluar las lesiones cutáneas emergentes en estos pacientes, y determinar la derivación a especialista. Algunas pueden aparecer asociadas al propio tratamiento farmacológico como los anti-TNF (psoriasis, melanoma) y tiopurinas (carcinoma espinocelular y basocelular).
Las terapias inmunosupresoras y biológicas pueden aumentar el riesgo de padecer infecciones oportunistas (incluyendo la reactivación de una tuberculosis latente), y por tanto, deben tenerse en cuenta imitadores de la EC activa como infecciones por Clostridium difficile y patógenos entéricos y tratarlas precozmente con la antibioterapia adecuada. Ante la presencia de un herpes zóster, deben suspenderse tiopurinas y biológicos, instaurar tratamiento precoz antiviral (brivudina contraindicada) y derivar a Urgencias si existe afectación oftálmica para terapia intravenosa.
VACUNAS EN EL CROHN(3)
Independientemente de la situación inmunitaria, todos los pacientes deben ser vacunados de gripe y neumococo, cribado de hepatitis A y B previo a tratamiento inmunosupresor. Si el paciente está inmunodeprimido, deben evitarse las vacunas con microorganismos vivos o atenuados (triple vírica, varicela?), siendo aconsejable esperar a suspender los corticoides o a recibir una dosis baja del tratamiento para su administración. Durante el embarazo las vacunas indicadas son las del tétanosdifteria y la de la gripe.
CÁNCER COLORRECTAL Y ENFERMEDAD DE CROHN (3 )
El riesgo de cáncer colorrectal (CCR) está aumentado. El riesgo aumenta según la duración y extensión de la enfermedad, y la existencia de otros factores como la presencia de CEP, historia familiar de CCR e inflamación histológica. Según el GETECCU, el seguimiento con colonoscopia para el cribado de CCR en estos pacientes se recomienda después de los 8 años del diagnóstico, con una periodicidad variable de entre 1 y 5 años en función de la presencia o no de factores de riesgo. Se recomienda un seguimiento anual en los pacientes con CEP. En el caso de la proctitis, no existe mayor riesgo de neoplasia y por tanto no requieren de seguimiento endoscópico.
Bibliografía
1. Costa Ribas C; Castiñeira Pérez C. Enfermedad de Crohn. [Revista en Internet] 2017
[consultado 15 de octubre de 2020]. Disponible en: https://www.fisterra.com/guias-clinicas/
enfermedad-crohn/
2. Gomollón F, Marín Jiménez I. Año 1932: descripción inicial detallada de la enteritis regional.
Gastroenterol Hepatol. 2020; 43 (7): 363?364. Disponible en:
https://doi.org/10.1016/j.gastrohep.2020.02.001
3. Riestra S, Castaño-García A, de Francisco R, Pérez-Martínez I. Enfermedad inflamatoria
intestinal: aspectos prácticos para el médico de familia. FMC. 2019;26(4):195-204
4. Guardiola J, Lobaton T, Cerrillo E, Ferreiro-Iglesias R, Gisbert JP, Domènech E, et al.
Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa
(GETECCU) sobre la utilidad de la determinación de calprotectina fecal en la enfermedad
inflamatoria intestinal. Gastroenterol. Hepatol. 2018; 41(8):514-529.
5. Gompertz M, Sedano R. Manifestaciones clínicas y endoscópicas en enfermedad inflamatoria
intestinal. Rev. Med. Clin. Condes. 2019; 30(4) 273-282.
6. GETECCU. Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa [Sede Web].
Bilbao: GETECCU;1990 [actualizada año 2020; acceso 10 de noviembre de 2020]. Disponible
en: https://geteccu.org/
7. Lichenstein G, Loftus E, Isaacs K, Regueiro M, Gerson L, Sands B. ACG Clinical Guidline:
Management of Crohn?s Disease in Adults. American Journal of Gastroenterology [Revista en
Internet]. 2018 [consultado 15 de octubre de 2020]; 113 (36): 481-517. Disponible en:
https://journals.lww.com/
|
Indicaciones y efectos secundarios de la terapia farmacológica en la EC |
|||||
|
Clasificación |
Ejemplos |
Dosis |
Indicaciones |
Efectos secundarios |
Comentario |
|
Corticoides orales |
Prednisona Dexametasona Daflazacort Hidrocortisona |
Descenso 10 mg a la semana hasta llegar a 20 mg y desde ahí 5 mg a la semana hasta suspender
|
Inducción de la remisión (brote moderado-grave de EC ileocecal y leve-moderado de EC colon) |
Infecciones, gastritis, diabetes, infarto cardiaco, efectos psiquiátricos, osteoporosis? |
Asociar vitamina D y calcio para prevenir pérdida de masa ósea |
|
Corticoides tópicos |
Budesonida
|
Dosis inicio: 9 mg/día, 1-2 meses, bajando 3 mg cada 1-2 meses hasta suspender |
Inducción de la remisión de brote leve de EC ileocecal y leve-moderado de EC ileocolónico |
Los mismos que los sistémicos pero más leves |
|
|
Tiopurinas
|
Azatioprina 2-2,5 mg/kg/día
Mercaptopurina 1-1,5 mg/kg/día
Mecanismo lento (3-6 meses) |
Mantenimiento de la remisión (EC corticodependiente o corticorresistente)
EC perianal |
Infecciones, mielotoxicidad, tumores (linfoma), fibrosis hepática, neumonitis? |
Prevenir infecciones (vacunas).
Pedir hemograma y pruebas hepáticas cada 3-4 meses. |
|
|
Metrotexato |
Inducción: 25 mg s.c. semanal (al menos 12 semanas) Mantenimiento 15 mg s.c. semanal |
Inducción y mantenimiento en EC corticodependiente Alternativa a tiopurinas si hay intolerancia o contraindicación |
Náuseas, vómitos, artromialgias, astenia, fibrosis hepática, neumonitis, infecciones |
Asociar folato 5 mg a la semana, 24-48 h tras metotrexato
Control analítico cada 3-6 meses. |
|
|
Agentes biológicos |
Infliximab: 5 mg/kg, vía i.v. semanas 0, 2, 6 y mantenimiento cada 8 semanas Adalimumab: 160 mg s.c., 80 mg s.c. en semana 2 y seguir con 40 mg s.c. cada 2 semanas Golimumab: 200 mg s.c., 100 mg en semana 2 y seguir con 50-100 mg cada 4 semanas Vedolizumab: 300 mg i.v. en semanas 0, 2 y 6 y mantenimiento con 300 mg cada 8 semanas Ustekinumab: 260-520 mg i.v. (según peso); mantenimiento con 90 mg s.c. cada 8-12 semanas
|
Inducción y mantenimiento de la remisión en EC corticodependiente
Alternativa a tiopurinas si hay intolerancia o contraindicación |
Infecciones (tuberculosis), reacciones a la infusión, psoriasis, lupus, leucopenia? |
Cribado de tuberculosis latente previo y tratamiento si precisase con isoniazida (3-4 semanas antes)
Prevenir infecciones mediante vacunas. |
|
|
Adaptado de Riestra S, Castaño-García A, de Francisco R, Pérez-Martínez I. Enfermedad inflamatoria intestinal: aspectos prácticos para el médico de familia. FMC. 2019;26(4):195-204
|
|||||

