UN NUEVO TRATAMIENTO EN LA HIPERTENSIÓN ARTERIAL RESISTENTE. APROCITENTAN (Antagonistas de receptores de endotelina)
Autor: Enrique Martín Rioboó
Médico de Familia. Doctor en medicina. UGC Poniente. Profesor asociado del Departamento de Medicina. Universidad de Córdoba. Grupo de Hipertensión Arterial y Enfermedad Cardiovascular de SEMERGEN.
Una nueva forma de tratar la hipertensión arterial (HTA) ha tardado en llegar.
La última novedad de una nueva clase de fármacos antihipertensivos, llamados inhibidores de la renina, fue en 2007 con la aprobación de Aliskiren por parte de la agencia estadounidense de fármacos -FDA- (Food an Drugs Administration), y de la agencia europea del medicamento EMA (European Medicine Agency). De hecho, esta nueva incorporación fue posteriormente restringida para su uso. (https://ec.ruropa.eu/health/documents/community-register/2021?20211220154437/dec_154437:es.pdf)
Posteriormente hubo algunos intentos fallidos en la búsqueda de nuevas sustancias y nuevos mecanismos de acción. Destacaron el mibefradil, un nuevo antagonista del calcio inhibidor selectivo de los canales T, que llegó a ser aprobado en algunos países (no así en España por sus efectos secundarios cardiovasculares y sus múltiples interacciones graves farmacológicas), y el omapatrilato, inhibidor de las vasopeptidasas (Inhibición dual de la neprilisina y del receptor de la angiotensina-ARNI-, que tampoco llegó a comercializarse.
Una nueva sustancia, APROCITENTAN (1,2), acaba de ser aprobada para su comercialización en EEUU el 19 de marzo de 2024, con el nombre comercial de Tryvio®, como un nuevo fármaco para el tratamiento de pacientes con hipertensión resistente (HR). En Europa, se ha iniciado un proceso de pre-autorización el 20 de Marzo de 2024.
(https://www.ema.europa.eu/en/documents/agenda/agenda-chmp-meeting-18-21-march-2024_en.pdf)
Como novedad, utiliza una vía terapéutica nueva para reducir la presión arterial (PA), el antagonismo de los receptores de la endotelina (ARE). (Figura 1)
Figura 1.- Mecanismo de los receptores de la endotelina (Adaptado de referencia 6)
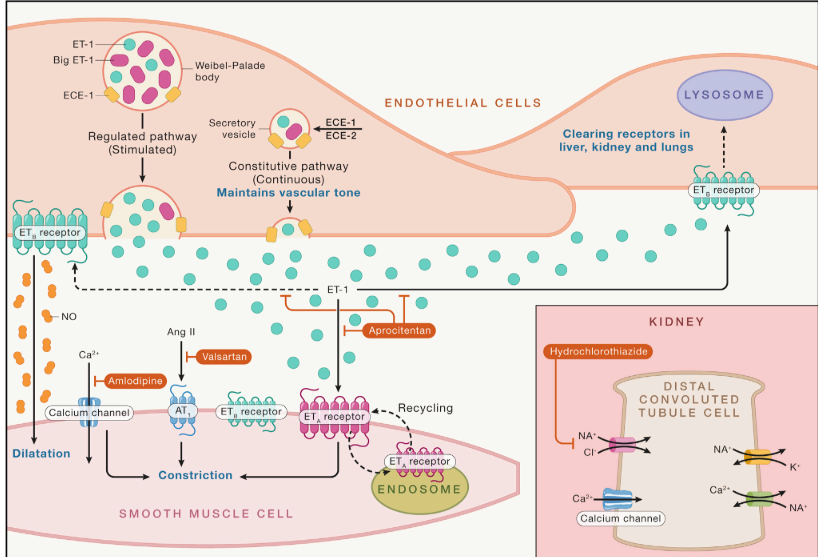
Las endotelinas son un grupo de péptidos descubiertos en 1988 por Yanagisawa (3), producidas por las células endoteliales (ET-1) y que son unas de las sustancias vasoconstrictoras más potentes conocidas hasta el momento. Las acciones de las endotelinas ET-1 en los seres humanos están mediadas a través de los receptores ETa (presentes en células musculares lisas de los vasos) y ETb (presentes en células endoteliales).
En la última década del siglo pasado se intentó comercializar como hipotensor la primera molécula de esta familia, el bosentan, pero fue finalmente desechada por sus efectos secundarios (rubicundez facial, edemas, hepatotoxicidad y problemas cardiovasculares) (4). Los estudios iniciales con ARE como bosentan y darusentan demostraron un efecto reductor de la PA en pacientes con HTA esencial e HR, sin causar activación neurohormonal refleja, aunque finalmente no fueron admitidos para su utilización en esta indicación. Sin embargo los ARE (Bosentan, Ambrisentan y Macitentan) si han sido aprobados para su utilización en hipertensión arterial pulmonar (5).
Es conveniente recordar que este fármaco ha sido aprobado, según el documento de ficha técnica (https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/217686s000lbl.pdf), para el tratamiento de la HTA, en combinación con otros antihipertensivos (no se puede utilizar en monoterapia), en adultos que no están adecuadamente controlados. La dosis recomendada de Tryvio® es 12,5 mg por vía oral una vez al día con o sin comida (no se ha aprobado la dosis de 25 mg). No se requiere ajuste de dosis por insuficiencia renal o hepática. Como contraindicación, las personas embarazadas y cualquier mujer que intente quedarse embarazada no deberían tomar este fármaco por su efecto teratogénico (puede provocar abortos espontáneos y malformaciones fetales). Las mujeres que están amamantando también deben evitarlo porque no se sabe con certeza si el medicamento pasa de la leche materna al bebé. De hecho se recomienda iniciar el tratamiento en mujeres en edad fértil solo después de una prueba de embarazo negativa, debiendo realizar pruebas mensuales durante el tratamiento y un mes después de la interrupción del mismo.
La utilidad de los ARE a menudo se ve restringida por su tolerabilidad, con retención de líquidos, edema y hepatotoxicidad (6-8). En el ensayo clínico en fase 3 PRECISION (9) el evento adverso más recurrente fue edema o retención de líquidos de leve a moderado, que ocurrió en el 9%, 18% y 2% de los pacientes que recibieron aprocitentan 12,5 mg, 25 mg y placebo durante el doble ciego de 4 semanas. Respecto a la hepatotoxicidad ensayos clínicos adicionales indican que no hay empeoramiento de la misma en pacientes que presentan síntomas leves o graves de insuficiencia hepática, lo que confirma que no se necesite ajuste de dosis de aprocitentan en pacientes con función hepática anormal.
Los efectos secundarios de aprocitentan más prevalentes son:
- hepatotoxicidad e insuficiencia hepática: se aconseja medir en el suero niveles de aminotransferasas y bilirrubina total antes del inicio del tratamiento tratamiento y repetirlo periódicamente durante el mismo. No iniciar el fármaco si las transaminasas están elevadas > 3 veces el l.s.n, o > 2 veces la bilirrubina.
- retención de líquidos (Edemas)*.
- disminución de la hemoglobina (Anemia)*.
- disminución del recuento de espermatozoides.
* Efectos secundarios frecuentes (>2%).
Como medidas de seguridad añadidas se añade en ficha técnica lo siguiente:
- Este medicamento sólo está aprobado para su uso con otros medicamentos antihipertensivos.
- Las personas embarazadas y cualquier persona que intente quedar embarazada no deben tomar Tryvio® porque el medicamento puede provocar abortos espontáneos y malformaciones fetales.
- Las personas que están amamantando también deben evitar Tryvio® porque no se sabe si el medicamento pasa de la leche materna al bebé
- Iniciar el tratamiento con Tryvio® en mujeres en edad fértil solo después de la confirmación.
de una prueba de embarazo negativa.
- Los pacientes deben excluir el embarazo y realizar pruebas mensuales durante el tratamiento y un mes después de la interrupción del tratamiento con Tryvio®
Otras consideraciones en ficha técnica:
Antes de tomar Tryvio®, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
- tiene problemas hepáticos.
- tiene insuficiencia cardíaca.
- tiene anemia.
- tiene problemas renales o recibe diálisis.
- está embarazada o planea quedar embarazada durante el tratamiento con Tryvio®. Tryvio® puede causar defectos de nacimiento graves.
- está amamantando o planea amamantar. No se sabe si Tryvio pasa a la leche materna. No amamante si toma Tryvio®.
El estudio PRECISION (9) es el que sustenta su autorización. En él participaron 730 pacientes con presión arterial sistólica en el consultorio superior a 140 mm Hg a pesar del tratamiento con al menos 3 fármacos antihipertensivos. Se realizó en cuatro fases siendo la fase 1 de aleatorización (4 a 12 semanas), en la que todos los pacientes cambiaron sus terapias antihipertensivas (excepto betabloqueadores) por una terapia estándar con una polipíldora de amlodipino, valsartán e hidroclorotiazida, con dosis fijas de 5/160/25 mg o 10/160/25 mg, exigiéndose la dosis máxima tolerada; la fase 2 correspondió a la introducción del placebo (4 semanas) con diseño simple enmascarado; en la fase 3 se realizó el tratamiento aleatorizado (48 semanas) en la que los pacientes se aleatorizaron para recibir aprocitentan 12,5 mg, aprocitentan 25 mg o placebo (1:1:1), y posteriormente aprocitentan 25 mg, con un diseño doble ciego controlado con placebo; por último, en la fase 4 de seguimiento (30 días) en la que los pacientes continuaron su terapia estándar. Fueron reclutados pacientes con HR ; para ello se incluyeron con este propósito pacientes con HTA y cifras presión arterial sistólica (PAS) en consulta no controladas (PAS >140 mmHg) a pesar de encontrarse bajo tratamiento con al menos 3 fármacos antihipertensivos, excluyéndose al subgrupo de pacientes con HTA severa confirmada (grado 3). La PA media en el consultorio al inicio del estudio era de 153/88 mm Hg (aunque la PA ambulatoria media de 24 horas fue sólo de 138/83mmHg). La edad promedio de la los pacientes fue de 61 años, con un 60% de sexo masculino y un 12% de individuos afroamericanos. Entre los datos clínicos destacar que el índice de masa corporal basal promedio de los pacientes fue de 33 kg/m2 siendo el 69,2% obesos, el 54,1% tenían diabetes, el 22,2% enfermedad renal crónica en estadio 3-4 y el 19,6% insuficiencia cardíaca congestiva. El 62% de los pacientes estaba en tratamiento antihipertensivo con mas de 4 fármacos. El descenso de PA obtenido frente a placebo fue de aproximadamente 4 mmHg, lo cual obtuvo significación estadística; el cambio medio en la PA sistólica en el consultorio fue de 15 mm Hg con aprocitentan y de 11 mm Hg con placebo (es llamativo el potente efecto del placebo en este estudio). El efecto reductor de la PA pareció consistente entre los subgrupos definidos por edad, sexo, raza, IMC, filtrado glomerular inicial, índice albúmina/creatinina al inicio, antecedentes médicos de diabetes y entre diferentes metodologías de medición de la PA (medidas de PA en consulta sin sanitario -AOBP- y mediciones ambulatorias de la PA).
Las limitaciones del estudio que ha permitido su autorización son apreciables (8). Entre ellas destacarían un número pequeño de pacientes aleatorizados de aproximadamente 240 pacientes en cada grupo( aprocitentan 12.5, aprocitentan 25 mg y placebo) y una duración del ensayo limitada a 48 semanas, con 4 fases de tratamiento (si excluimos la fase de aleatorización), lo que disminuía aún más el tiempo en tratamiento para cada grupo; es por ello que, en este momento, se desconocen los efectos de la sustancia a largo plazo. Otra limitación sería el escaso descenso de la PA obtenido frente a placebo (3,8 mmHg con aprocitentan 12.5 y de 3.7 con aprocitetnan 25 mg), aunque hay que recordar que se trataba de pacientes con HR y previamente tratados con al menos tres fármacos hipertensivos. Otro punto que debería ser estudiado en posteriores ensayos, sería el objetivo primario ya que se limitó a investigar un resultado "intermedio", como es el descenso de PA al finalizar el mismo, frente a placebo. Y por último recordar que se produjeron algunos eventos adversos significativos, que podrían limitar su utilización, entre los que destacan la retención de líquidos que, como se comentó con anterioridad, afectó hasta al 18% de los pacientes con 7 retiradas por este efecto secundario en el grupo de aprocitentan.
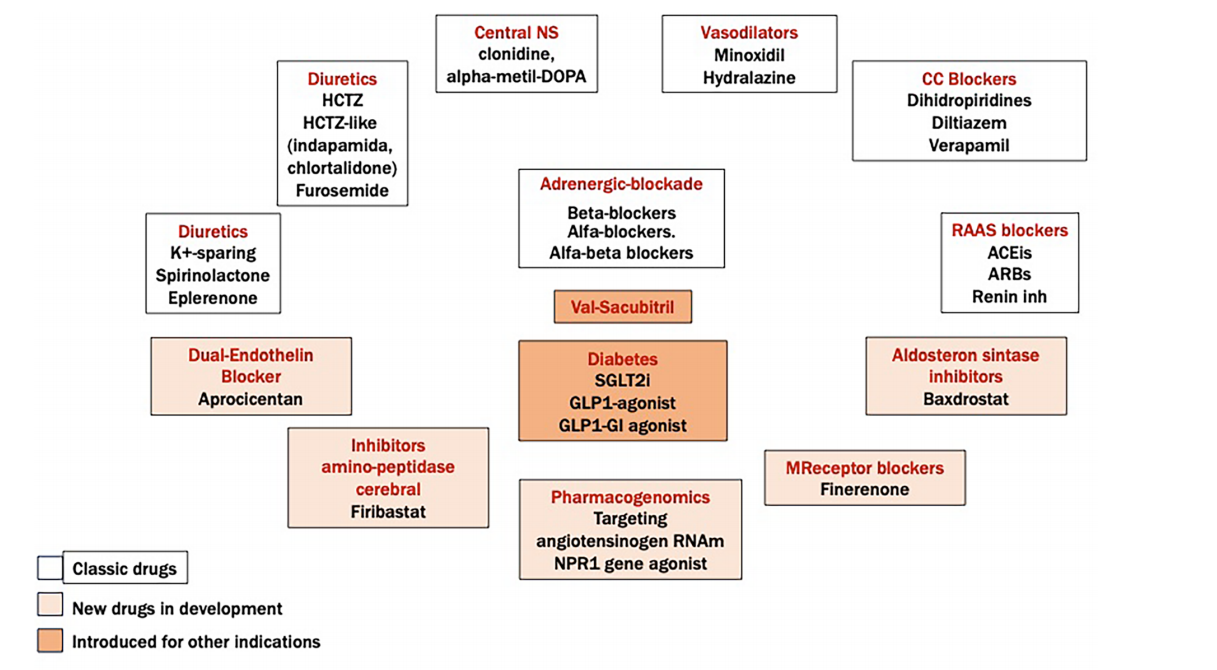
Otros nuevos fármacos en estudio para el tratamiento farmacológico de la HTA son los antagonistas de aldosterona sintasa (10), concretamente Baxdostrat tanto en HTA (11,12) como en HR (13) o larundrostat, y los Inhibidores del angiotensinógeno hepático; estos últimos están siendo analizados por terapia génica de dos formas, primero, un oligonucleótido anti sentido, IONIS-AGT-Lrx, que reduce los niveles plasmáticos de angiotensinógeno por bloqueo del ARNm en los hepatocitos, y por otro lado el uso de una pequeña interferencia molécula de interferencia (ARNip) (Zilebesirán) que bloquea la síntesis de ARNm de angiotensinógeno que se encuentra actualmente en estudios de fase 1 (14).
Una revisión reciente de dos autores españoles (14) atestigua el presente y el futuro del tratamiento en HTA. En la figura 2 se puede un resumen de los mecanismos de acción de las presentes y futuras dianas terapéuticas.
Figura 2.- Mecanismo de acción de actuales y futuras dianas terapéuticas en la HTA. (Con permiso de los autores referencia 14.
CONCLUSIÓN
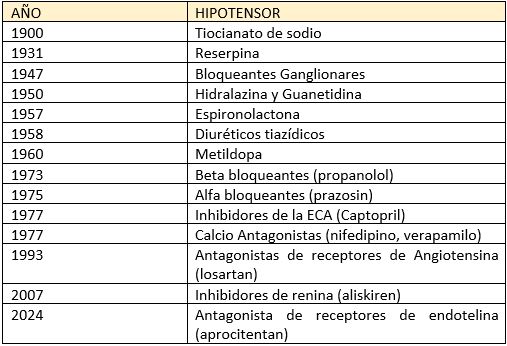
Estamos ante una nueva molécula en el tratamiento de la HTA, concretamente para la HTR, tras 17 años de sequía en la aparición de nuevos fármacos para la HTA esencial. En la tabla 1 podemos recordar cuales fue el histórico de comercialización de hipotensores durante el siglo XX y el siglo XXI en el mundo, y cuales fueron estas sustancias (15).
Se trata de una sustancia que, al igual que sus homólogos comercializados (darusentan, bosentan y macitentan), antagoniza los receptores de la endotelina. Hasta ahora, estos fármacos habían sido aprobados únicamente en el tratamiento de la HTA pulmonar, aunque con destacados efectos secundarios entre los que destacan la hipertransaminasemia, la naso-faringitis aguda, la cefalea, la rubefacción, los edemas y la teratogenicidad. La mayoría de estos efectos son compartidos por aprocitentan (16).
Es el primer ARE dual, aprobado en HR, pero únicamente en combinación con otros fármacos, no en monoterapia.
La aprobación de esta sustancia se ha producido tras casi dos años de estudio por la FDA, y con un único estudio que avala su utilización.
Aunque la búsqueda de nuevas sustancias hipotensoras debe apremiar la investigación no debemos dejarnos llegar por este ímpetu en dar el visto bueno a esta sustancia sin conocer sus limitaciones.
Entre ellas destacarían las del estudio y el número limitado de pacientes que da origen a su aprobación, los efectos secundarios como los edemas y la anemia o la teratogenia, la ausencia de objetivos finales de morbimortalidad, y el escaso efecto hipotensor de la misma (aunque bien es cierto que eran pacientes con HR). De hecho su teratogenicidad que contraindica la utilización en gestantes, y la limita en mujeres fértiles, unido a la existencia de edemas que podría limitar su uso en algunos pacientes, sobre todo con insuficiencia cardíaca, nos hace que tengamos que estar alerta.
Por último, como recuerdan algunos autores (17), faltarían estudios que comparen esta sustancia con el actual patrón oro en la HR como cuarto fármaco como es la espironolactona (18 ; de hecho, no existe ningún estudio comparador con espironolactona en este ámbito y desconocemos si podrá sustituir a los antagonistas de aldosterona con esta indicación.
TABLA 1.- Hitos históricos en la comercialización de antihipertensivos en el S. XX y S. XXI. (Adaptado de referencia 15)
Recordar que aún está pendiente de aprobación por la EMA, y, a la espera de lo que pueda objetar la agencia europea y consecuentemente la agencia española del medicamento (AEMPS), aun queda mucha tela que cortar en este campo.
PUNTOS A DESTACAR:
- Nueva sustancia (antagonistas de la endotelina) aprobada para el uso en HTA que no responda a otros fármacos en HR.
- Un sólo estudio avala su uso, con limitaciones objetivas.
- Dosis única de 12.5 mg/d. Solo aprobación en combinación con otros fármacos
- Escasa, aunque significativa, bajada de PA en los pacientes.
- Efectos secundarios: Edemas, Anemia y alteraciones hepáticas
- Teratogénico. Contraindicado en lactancia y precaución en mujeres fértiles
- Ausencia de estudios comparativos con el patrón oro actualmente, espironolactona, y necesidad de realizar otros estudios que comprueben estos efectos, preferentemente con resultados finales de morbimortalidad.
Agradecimiento al Dr. Rafael Santamaría Olmo, nefrólogo, Hospital Reina Sofía (Córdoba) por su revisión.
BIBLIOGRAFÍA
- Approved Tryvio label. U.S. Food and Drug Administration; 2024 Mar 19.
- Campbell P. FDA approves aprocitentan (Tryvio) for treatment-resistant hypertension. HCP Live. 2024 Mar 20. (https://www.hcplive.com/view/fda-approves-aprocitentan-tryvio-for-treatment-resistant-hypertension) (https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/217686s000lbl.pdf)
- Yanagisawa M, Kurihara H, Kimura S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988;332:411-415.
- Krum H, Viskoper RJ, Lacourciere Y, Budde M, Charlon V. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators. N Engl J Med. 1998 Mar 19;338(12):784-90
- Goldberg A.B., Mazur W., Kalra D.K. Pulmonary hypertension: Diagnosis, imaging techniques, and novel therapies. Diagn. Ther. 2017;7:405-417
- Abraham GR, Davenport AP. From ABCD to E for endothelin in resistant hypertension. Cell. 2023;186(2):240-2..
- Yao Y, Fan B, Yang B, Jia Z, Li B. Aprocitentan: A new development of resistant hypertension. J Clin Hypertens (Greenwich). 2023 Jul;25(7):587-590.
- Heidari S, Azzam O, Schlaich MP. Dual Endothelin Antagonism with Aprocitentan as a Novel Therapeutic Approach for Resistant Hypertension. Curr Hypertens Rep. 2023;25(10):343-352
- Schlaich MP, Bellet M, Weber MA, Danaietash P, Bakris GL, Flack JM, et al. PRECISION investigators. Dual endothelin antagonist aprocitentan for resistant hypertension (PRECISION): a multicentre, blinded, randomised, parallel-group, phase 3 trial. Lancet 2022;400:1927-1937.
- Zoccali C, Mallamaci F, De Nicola L, Minutolo R. New trials in resistant hypertension: mixed blessing stories. Clin Kidney J. 2023;17(1):sfad251. doi: 10.1093/ckj/sfad251.
- Freeman MW, Halvorsen YD, Marshall W, Pater M, Isaacsohn J, Pearce C, et al. BrigHTN Investigators. Phase 2 Trial of Baxdrostat for Treatment-Resistant Hypertension. N Engl J Med. 2023;388(5):395-405.
- Dey S, Frishman WH, Aronow WS. Baxdrostat: An Aldosterone Synthase Inhibitor for the Treatment of Systemic Hypertension. Cardiol Rev. 2023 Aug 7. doi: 10.1097/CRD.0000000000000595.
- Forzano I, Mone P, Varzideh F, Jankauskas SS, Kansakar U, De Luca A,et al. The selective aldosterone synthase inhibitor Baxdrostat significantly lowers blood pressure in patients with resistant hypertension. Front Endocrinol (Lausanne). 2022 Dec 9;13:1097968. doi: 10.3389/fendo.2022.1097968.
- Redon J, Carmena R. Present and future of drug therapy in hypertension: an overview. Blood Press. 2024 Dec;33(1):2320401. doi: 10.1080/08037051.2024.2320401
- Kotchen TA. Historical Trends and Milestones in Hypertension Research A Model of the Process of Translational Research. 2011; 58: 522-538
- Boutari C, Siskos F. Novel Dual Endothelin Inhibitors in the Management of Resistant Hypertension. Life (Basel). 2023 Mar 16;13(3):806. doi: 10.3390/life13030806.
- Rodriguez D. ¿Es el aprocitentan, un antagonista dual de la endotelina, eficaz para mejorar el control de la tensión arterial en los pacientes con hipertensión resistente" Resúmenes estructurados, comentados y evaluados de la literatura nefrológica. Nefroplus 2023;15:29-34
- Williams B, Mc DonadT, Morant S, Webb DJ, Sever P, Mcinnes G et al. Spironolactone versus placebo, bisoprolol, and doxazosin to dtermin the optimal treatment for drug-resistant hypertension (PATHWAY-2) a randomised dobule-blind corossover trial. The lancet 2015;386:2059-68

